Cómo los transportadores de carnitina mejoran la salud reproductiva
 Por Tarun Sai Lomte Revisado por Susha Cheriyedath, M.Sc. 6 oct 2024
Por Tarun Sai Lomte Revisado por Susha Cheriyedath, M.Sc. 6 oct 2024 
Entender cómo los transportadores de carnitina regulan la motilidad de los espermatozoides y la producción de hormonas podría desbloquear nuevos tratamientos de fertilidad, ofreciendo esperanzas a millones de personas afectadas por la infertilidad en todo el mundo.
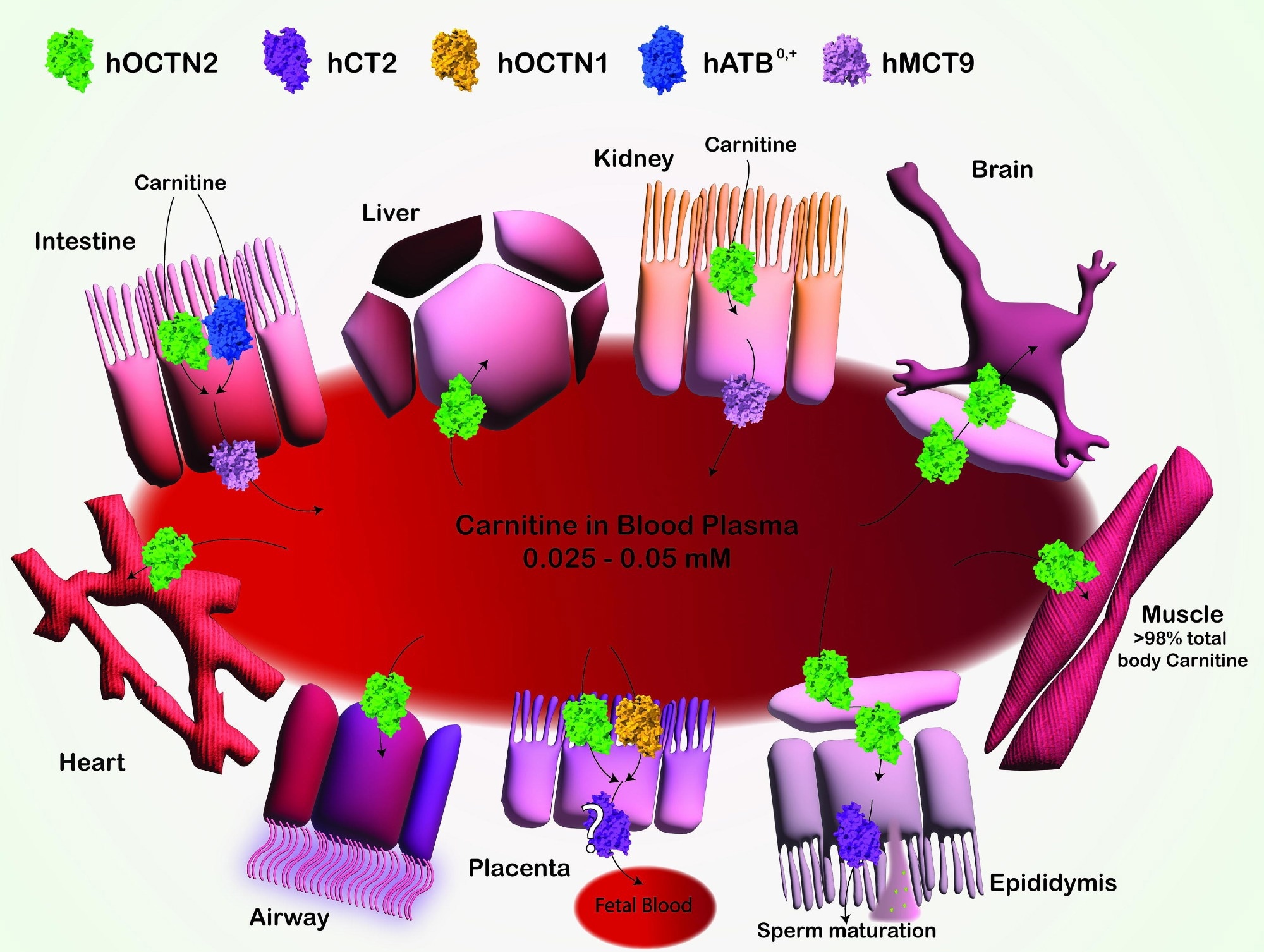 Representación esquemática del transporte y distribución de carnitina en diversos tejidos. El transporte de carnitina mediado por múltiples SLC se representa con diferentes colores. Se muestra el transporte de carnitina a través de las células epiteliales del intestino, riñón y placenta, así como hacia el hígado, cerebro, corazón, músculo, epidídimo y tejidos de las vías respiratorias. OCTN2 (verde): interviene en el transporte de carnitina mediante un mecanismo dependiente del sodio, del que no se informa en aras de la claridad. CT2 (púrpura): participa en el transporte de carnitina, concretamente en el epidídimo, contribuyendo a la maduración del esperma. OCTN1 (Amarillo): Transportador de carnitina de baja afinidad, participa en el transporte de carnitina en diversos tejidos. ATB0,+ (Azul): media el transporte de carnitina dependiente de sodio y cloruro, del que no se informa en aras de la claridad, en el intestino y otros tejidos. MCT9 (rosa): transportador asociado al eflujo de carnitina a través de la membrana basolateral de epitelios de absorción como el intestino y el riñón. Las flechas indican la dirección del transporte de carnitina a través de las membranas celulares. Imagen creada con Adobe Illustrator. Los transportadores humanos se representan como modelos de relleno espacial de AlphaFold
Representación esquemática del transporte y distribución de carnitina en diversos tejidos. El transporte de carnitina mediado por múltiples SLC se representa con diferentes colores. Se muestra el transporte de carnitina a través de las células epiteliales del intestino, riñón y placenta, así como hacia el hígado, cerebro, corazón, músculo, epidídimo y tejidos de las vías respiratorias. OCTN2 (verde): interviene en el transporte de carnitina mediante un mecanismo dependiente del sodio, del que no se informa en aras de la claridad. CT2 (púrpura): participa en el transporte de carnitina, concretamente en el epidídimo, contribuyendo a la maduración del esperma. OCTN1 (Amarillo): Transportador de carnitina de baja afinidad, participa en el transporte de carnitina en diversos tejidos. ATB0,+ (Azul): media el transporte de carnitina dependiente de sodio y cloruro, del que no se informa en aras de la claridad, en el intestino y otros tejidos. MCT9 (rosa): transportador asociado al eflujo de carnitina a través de la membrana basolateral de epitelios de absorción como el intestino y el riñón. Las flechas indican la dirección del transporte de carnitina a través de las membranas celulares. Imagen creada con Adobe Illustrator. Los transportadores humanos se representan como modelos de relleno espacial de AlphaFold
Los investigadores planean revisar el efecto del SARS-CoV-2 en la salud reproductiva masculina
Estudio: Los alumnos del Reino Unido pueden abandonar la escuela sin conocimientos vitales sobre salud sexual y reproductiva
Un reciente estudio publicado en la revista Biochemical Pharmacology revisa el papel de los transportadores de membrana en la homeostasis de la carnitina, centrándose en los mecanismos moleculares implicados y las implicaciones en la fertilidad. La carnitina es una molécula crucial en el metabolismo. Impulsa principalmente la β-oxidación de los ácidos grasos en las mitocondrias y desempeña un papel importante en el mantenimiento de la flexibilidad metabólica. La dieta es la principal fuente de carnitina en los seres humanos, y sólo una pequeña parte se sintetiza de forma endógena. La biosíntesis de carnitina requiere el flujo de sus intermediarios a través de las membranas de diferentes orgánulos, y la mayor parte de la síntesis de carnitina se produce en el hígado, con síntesis adicional en los riñones y el cerebro. Como tal, la carnitina y sus metabolitos se distribuyen a los tejidos y orgánulos mediante transportadores de membrana.
El papel de la carnitina en la salud cerebral: Además de la fertilidad, la carnitina está implicada en la plasticidad cerebral y las funciones cognitivas, y la acetilcarnitina influye en la expresión génica a través de la acetilación de histonas.
El sistema primario de transporte de carnitina en las mitocondrias comprende dos enzimas (carnitina palmitoil transferasa 1 [CPT1] y CPT2) y un transportador de la membrana mitocondrial interna, el transportador de carnitina/acilcarnitina (CAC), también conocido como transportador de solutos 25 miembro 20 (SLC25A20). El CAC es crucial para el transporte de acilcarnitinas a las mitocondrias para su β-oxidación. Notablemente, ningún transportador mitocondrial redundante compensa la deficiencia de CAC, haciéndolo indispensable para la vida celular. Otras lanzaderas de carnitina están activas en el retículo endoplásmico y los peroxisomas.
La coordinación de las lanzaderas de carnitina peroxisomal y mitocondrial es esencial para el catabolismo de los ácidos grasos. Se ha implicado a la carnitina en la modulación de la proporción de acetil-coenzima A (CoA)-a-CoA, que afecta profundamente a la biosíntesis de lípidos, la expresión génica y el metabolismo de los hidratos de carbono. En el presente estudio, los investigadores revisaron el papel de los transportadores en el tráfico de carnitina, centrándose en la relación entre carnitina y fertilidad.
Red de carnitina y alteraciones
La distribución de la carnitina es muy variable en los tejidos, desde niveles milimolares bajos en la mayoría de los tejidos hasta los más altos (60 mM) en los testículos. Muchos transportadores participan en el mantenimiento de la homeostasis de la carnitina. La dieta desempeña un papel crucial en la distribución de la carnitina; en los consumidores de pescado y carne, la carnitina de la dieta representa alrededor del 75% del contenido total de carnitina. En cambio, los veganos y vegetarianos suelen depender en gran medida de la síntesis endógena y la reabsorción renal para mantener los niveles de carnitina. Sin suplementos, los veganos y vegetarianos pueden experimentar niveles reducidos de carnitina.
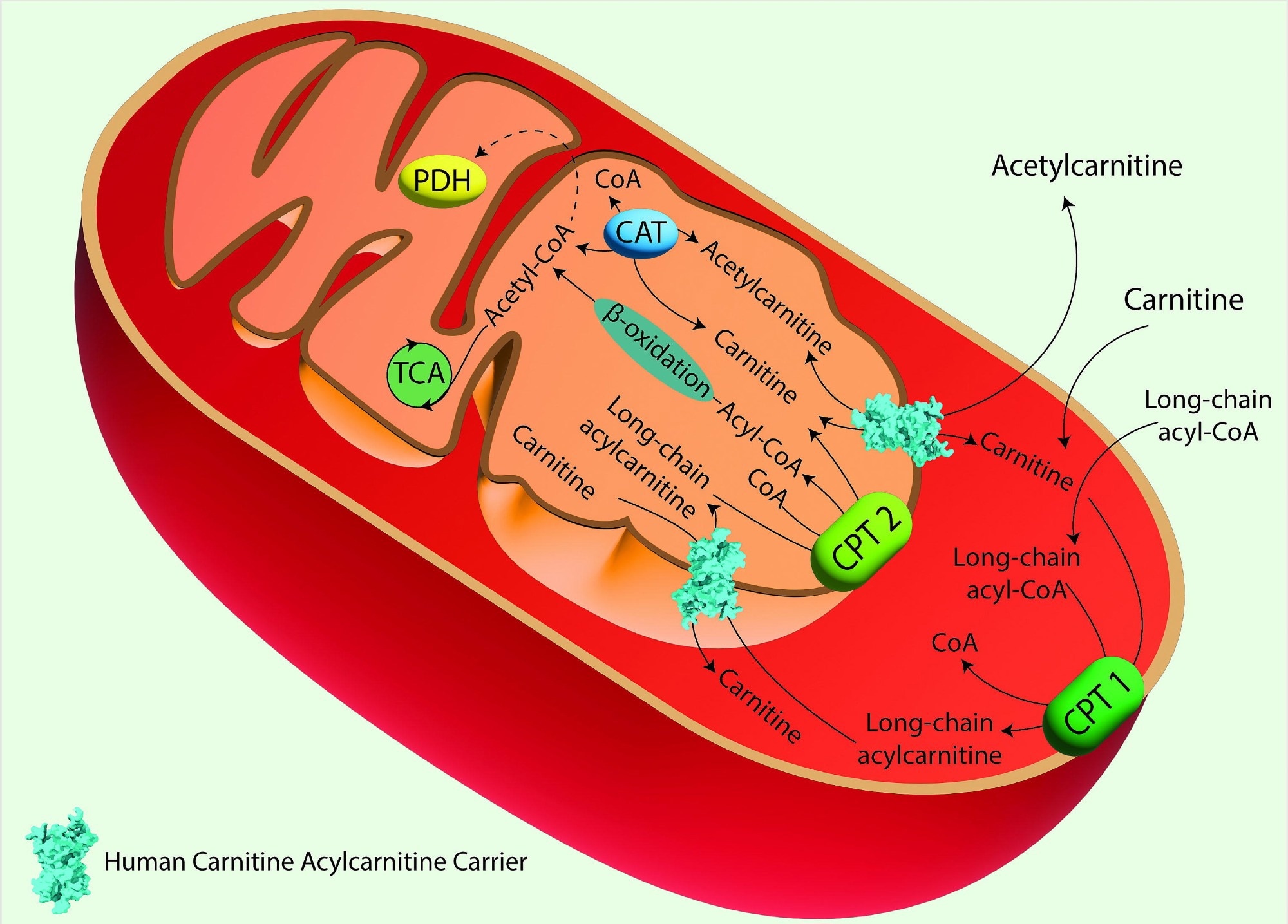 La lanzadera de carnitina en la oxidación mitocondrial de ácidos grasos. La acil-CoA sintasa cataliza la conversión de ácidos grasos de cadena larga en acil-CoA grasos. A continuación, éstos son convertidos en acilcarnitinas por la carnitina palmitoil transferasa 1 (CPT 1), que se encuentra en la membrana mitocondrial externa. Las acilcarnitinas son transportadas a través de la membrana mitocondrial interna por el Transportador de Carnitina/Acilcarnitina (CAC) a cambio de carnitina libre. Una vez dentro de la matriz mitocondrial, la carnitina palmitoil transferasa 2 (CPT 2), situada en la membrana mitocondrial interna, convierte las acilcarnitinas de nuevo en acil-CoAs y carnitina libre. La carnitina libre es transportada al citosol por la CAC, y puede ser reciclada por la CPT 1. Los acil-CoAs importados a la matriz mitocondrial a través del transportador de carnitina se someten a β-oxidación, produciendo acetil-CoA, que puede entrar en el TCA. Imagen creada con Adobe Illustrator. hCAC se representa como modelo de relleno espacial a partir de la predicción de AlphaFold
La lanzadera de carnitina en la oxidación mitocondrial de ácidos grasos. La acil-CoA sintasa cataliza la conversión de ácidos grasos de cadena larga en acil-CoA grasos. A continuación, éstos son convertidos en acilcarnitinas por la carnitina palmitoil transferasa 1 (CPT 1), que se encuentra en la membrana mitocondrial externa. Las acilcarnitinas son transportadas a través de la membrana mitocondrial interna por el Transportador de Carnitina/Acilcarnitina (CAC) a cambio de carnitina libre. Una vez dentro de la matriz mitocondrial, la carnitina palmitoil transferasa 2 (CPT 2), situada en la membrana mitocondrial interna, convierte las acilcarnitinas de nuevo en acil-CoAs y carnitina libre. La carnitina libre es transportada al citosol por la CAC, y puede ser reciclada por la CPT 1. Los acil-CoAs importados a la matriz mitocondrial a través del transportador de carnitina se someten a β-oxidación, produciendo acetil-CoA, que puede entrar en el TCA. Imagen creada con Adobe Illustrator. hCAC se representa como modelo de relleno espacial a partir de la predicción de AlphaFold
Por ello, la síntesis y reabsorción endógenas pueden ser más relevantes para la homeostasis. La reabsorción renal de carnitina es el principal medio para compensar las deficiencias de carnitina en la dieta. El transportador orgánico de cationes/carnitina 2 (OCTN2) facilita la reabsorción de carnitina en los riñones; las mutaciones en OCTN2 conducen a la deficiencia primaria de carnitina (PCD), un trastorno caracterizado por el agotamiento sistémico de carnitina y manifestaciones clínicas asociadas, como debilidad muscular, cardiomiopatía e infertilidad. El tratamiento de la PCD consiste en la administración de suplementos de carnitina durante toda la vida.
Deficiencia de carnitina en el autismo: Las mutaciones en enzimas implicadas en la biosíntesis de carnitina se han relacionado con trastornos del espectro autista, lo que indica un impacto sistémico más amplio de la carnitina más allá de la fertilidad.
Las deficiencias secundarias de carnitina (SCD) pueden deberse a defectos hereditarios en CPT2, CAC o acil-CoA deshidrogenasas. En particular, los defectos de la CAC a menudo provocan afecciones potencialmente mortales debido a la alteración de la β-oxidación mitocondrial, que conduce a una mayor acumulación de ácidos grasos en el citoplasma. No existen transportadores de carnitina redundantes para compensar los defectos del CAC. Por lo tanto, la intervención temprana es primordial para la deficiencia de CAC. Las estrategias de tratamiento de las ECM incluyen la prevención de la hipoglucemia inducida por la dieta, la suplementación con carnitina y las dietas con ácidos grasos de cadena media.
Carnitina y estrés oxidativo en la infertilidad
El estrés oxidativo desempeña un papel fundamental en la infertilidad masculina y femenina, ya que las especies reactivas del oxígeno (ROS) y las especies reactivas del nitrógeno (RNS) contribuyen a la peroxidación lipídica, la fragmentación del ADN y la reducción de la viabilidad del esperma. La carnitina, con sus propiedades antioxidantes, ayuda a mitigar el daño oxidativo al eliminar los radicales libres, protegiendo a las mitocondrias del esperma del estrés oxidativo, lo que es especialmente importante para preservar la movilidad de los espermatozoides y la fertilidad en general. El estudio también pone de relieve que la función antioxidante de la carnitina es crucial para controlar el estrés oxidativo en los tejidos reproductores femeninos, como los ovarios, donde los desequilibrios de ROS pueden perjudicar la calidad de los ovocitos y alterar el entorno endometrial.
Infertilidad humana
En todo el mundo, la infertilidad es un problema importante que afecta a más de 180 millones de parejas. Históricamente, se atribuía predominantemente a las mujeres; sin embargo, los conocimientos actuales ponen de relieve una importante contribución masculina. La causa de la infertilidad sigue sin explicarse en muchos casos a pesar de los avances en el diagnóstico. Las disfunciones mitocondriales se perfilan como un factor común en la infertilidad masculina y femenina, vinculando el metabolismo energético a la salud reproductiva. El estilo de vida influye en la fertilidad, y hay pruebas que relacionan el alcohol, la obesidad y el tabaquismo con la mala calidad del semen y la función ovulatoria.
Además, a pesar de los múltiples estudios sobre la relación entre la fertilidad masculina y la carnitina, los mecanismos moleculares subyacentes siguen siendo esquivos. En el sistema reproductor masculino, la carnitina facilita el metabolismo energético mitocondrial, en particular mediante la regulación de la relación acetilcarnitina/CoA, que supuestamente es responsable de la concentración y la motilidad de los espermatozoides. Esta regulación es especialmente importante en la maduración del esperma, donde las concentraciones de carnitina aumentan drásticamente desde la cabeza del epidídimo (5 mM) hasta la cola (60 mM).
Algunos estudios han sugerido que la carnitina lumen puede estabilizar la membrana plasmática de los espermatozoides, mejorar la supervivencia y mitigar los espermatozoides reaccionados al acrosoma, que son fundamentales para el éxito de la fecundación.
El papel de la carnitina en las hembras está menos claro. Sin embargo, la carnitina interviene en el suministro energético necesario para la ovulación, la foliculogénesis y el desarrollo embrionario. La disfunción mitocondrial, exacerbada por la deficiencia de carnitina, ha sido implicada en afecciones como el síndrome de ovario poliquístico (SOP) y la endometriosis. Por lo tanto, la deficiencia de carnitina podría dar lugar a una energía subóptima, comprometiendo la calidad de los ovocitos y reduciendo el potencial de fertilización. Además, se ha demostrado que la carnitina influye en la producción de hormonas sexuales como la testosterona, el estrógeno y la progesterona, que son cruciales para la salud reproductiva.
SLCs en la red de carnitina
Los estudios indican que OCTN1 podría funcionar como transportador de carnitina en tejidos con altos niveles de carnitina, como el epidídimo. Sin embargo, hasta ahora no se han estudiado los vínculos directos entre OCTN1 y la infertilidad. OCTN2 es el transportador de carnitina de mayor afinidad. Se expresa de forma ubicua en el corazón, el músculo esquelético, los riñones y el intestino. Las mutaciones en OCTN2 se asocian a la enfermedad de Crohn (EC) debido a la deficiencia de carnitina en el epitelio intestinal. Además, las mutaciones en OCTN2 pueden provocar problemas de fertilidad al alterar la homeostasis de la carnitina en el sistema reproductor, especialmente en el epidídimo. En el sistema reproductor masculino, el transportador de carnitina 2 (CT2) se localiza en la membrana luminal de las células epididimarias y en la membrana plasmática de las células de Sertoli en los testículos. En las mujeres, el CT2 se expresa en gran medida en el endometrio.
La localización de CT2 en los testículos es el principal vínculo molecular entre la infertilidad masculina y la carnitina; sin embargo, su presencia en el endometrio o los testículos no aclara si la carnitina está asociada a la regulación del transportador o a las necesidades energéticas. La CAC es una proteína indispensable para la vida celular. Aunque el estudio apunta al posible papel de la CAC en la infertilidad, aún no se han confirmado mutaciones causales directas que relacionen la CAC con la disfunción de la fertilidad.
Implicaciones clínicas
El estudio concluye sugiriendo posibles vías de tratamiento. La suplementación con carnitina ha demostrado ser prometedora para mejorar la motilidad y morfología espermáticas en casos de infertilidad idiopática, mientras que su papel en la defensa antioxidante pone de relieve su potencial terapéutico en trastornos reproductivos relacionados con el estrés oxidativo. Reconocer el papel de la carnitina y los SLC en la motilidad espermática y el metabolismo energético podría ayudar a desarrollar herramientas de diagnóstico avanzadas y más refinadas, así como terapias específicas. Son necesarias más investigaciones para comprender los mecanismos moleculares exactos que vinculan los transportadores de carnitina y la salud reproductiva, lo que podría conducir a tratamientos novedosos para la infertilidad masculina y femenina.